ที่มาและความสำคัญ
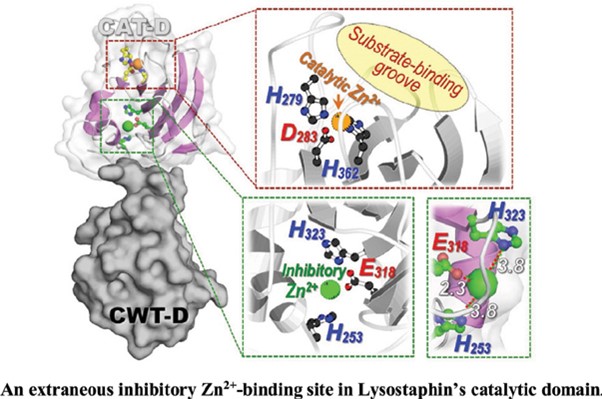
สารไลโซสตาฟิน(~28-kDa Lss) จาก Staphylococcus simulans พิสูจน์แล้วว่ามีประสิทธิภาพสูงเป็นยาต้านเชื้อ Staphylococcus aureus (MRSA) ที่ดื้อต่อ methicillin ซึ่งเป็นโรคเฉพาะถิ่นในโรงพยาบาลทั่วโลก Lss เป็นเอนโดเปปติเดสที่ขึ้นกับ Zn2+ แต่การสลายแบคทีเรียของมันอาจได้รับผลกระทบจากการเติม Zn2+ภายนอก เพื่อให้ได้ข้อมูลเชิงลึกมากขึ้นเกี่ยวกับผลกระทบเชิงโครงสร้างและหน้าที่ของ Zn2+และ Ni2+on Lss ที่เกิดจากฤทธิ์ทางชีวภาพ วิธีการ: Lss ถูกทำให้บริสุทธิ์ด้วยโครมาโตกราฟีที่มีไอออนของโลหะที่ถูกตรึงที่ถูกตรึงถูกประเมินสำหรับการออกฤทธิ์ทางชีวภาพโดยใช้การสอบวิเคราะห์การลดความขุ่น การเปลี่ยนแปลงโครงสร้างของ Lss ที่บำบัดด้วยไอออนของโลหะถูกตรวจสอบโดยการแบ่งแยกแบบวงกลมและสเปกโทรสโกปีเรืองแสงภายใน ทำการทดสอบการตกตะกอนร่วมเพื่อศึกษาปฏิสัมพันธ์ระหว่าง Lss ที่บำบัดด้วย Zn2+ และ S. aureus peptidoglycans การทำนายการจับไอออนของโลหะและการเทียบเคียงระหว่างโมเลกุลถูกใช้เพื่อค้นหาตำแหน่งการจับ Zn2+ ภายนอก ฤทธิ์ทางชีวภาพของ Lss ที่ลดลงอย่างมากต่อเชื้อ S. aureus และ MRSA เมื่อรับการรักษาด้วย Zn2+ เท่านั้น แต่ไม่ใช่ Ni2+แม้ว่าจะไม่ได้มีผลในทางลบของ diethyldithiocarbamate- Zn2+-chelator ต่อฤทธิ์ทางชีวภาพที่เกิดจาก Lss ไม่พบการเปลี่ยนแปลงรูปแบบที่รุนแรงสำหรับ Lss ที่ใช้ Zn2+ หรือ Ni2จากภายนอก Lss ที่มี Zn2+ ก่อนที่จับกับเปปติโดไกลแคนของผนังเซลล์ S. aureus อย่างมีประสิทธิภาพ ซึ่งแสดงถึงผลกระทบที่ไม่รบกวนของไอออนของโลหะจากภายนอกต่อผนังเซลล์ (CWT) ในการวิเคราะห์ซิลิโกเปิดเผยว่า Zn2+ จากภายนอก แต่ไม่ใช่ Ni2+มีปฏิสัมพันธ์กับไซต์ที่มีผลจาก Zn2+ จากภายนอกที่อาจเกิดขึ้น (His253, Glu318 และ His323) ที่อยู่ใกล้กับไซต์ Lss active ที่ประสาน Zn2+ ภายในโดเมนของตัวเร่งปฏิกิริยา (CAT)
Abstract
Background
Mature lysostaphin (~28-kDa Lss) from Staphylococcus simulans proves effective in killing methicillin-resistant Staphylococcus aureus (MRSA) which is endemic in hospitals worldwide. Lss is Zn2+-dependent endopeptidase, but its bacteriolytic activity could be affected by exogenously added Zn2+.
Objective
To gain greater insights into structural and functional impacts of Zn2+and Ni2+on Lss-induced bioactivity.
Methods
Lss purified via immobilized metal ion-affinity chromatography was assessed for bioactivity using turbidity reduction assays. Conformational change of metal ion-treated Lss was examined by circular dichroism and intrinsic fluorescence spectroscopy. Co-sedimentation assay was performed to study interactions between Zn2+-treated Lss and S. aureus peptidoglycans. Metal ionbinding prediction and intermolecular docking were used to locate an extraneous Zn2+-binding site.
Results
A drastic decrease in Lss bioactivity against S. aureus and MRSA was revealed only when treated with Zn2+, but not Ni2+, albeit no negative effect of diethyldithiocarbamate—Zn2+-chelator on Lss-induced bioactivity. No severe conformational change was observed for Lss incubated with exogenous Zn2+ or Ni2+. Lss pre-treated with Zn2+ efficiently bound to S. aureus cell-wall peptidoglycans, suggesting non-interfering effect of exogenous metal ions on cell-wall targeting (CWT) activity. In silico analysis revealed that exogenous Zn2+, but not Ni2+, preferably interacted with a potential extraneous Zn2+-binding site (His253, Glu318 and His323) placed near the Zn2+-coordinating Lssactive site within the catalytic (CAT) domain.
Conclusions
Our present data signify the adverse influence of exogenous Zn2+ ions on Lss-induced staphylolytic activity through the exclusive presence within the CAT domain of an extraneous inhibitory Zn2+-binding site, without affecting the CWT activity.
KEYWORDS: Inhibitory Zn2+-binding site, peptidoglycan binding, staphylolytic activity, Zn2+-chelation, metallopeptidase, methicillin- resistant Staphylococcus aureus.
Citation: Chen K, Ojha SC, Imtong C, Linn AK, Li HC, Thonabulsombat C, Angsuthanasombat C. Molecular Insights into Zn2+ Inhibition of the Antibacterial Endopeptidase Lysostaphin from Staphylococcus simulans. Protein Pept Lett. 2021;28(2):140-148.
DOI: 10.2174/0929866527666200613221359
RELATED SDGs:
SDG Goal หลัก ที่เกี่ยวข้อง
3. GOOD HEALTH AND WELL-BEING

ผู้ให้ข้อมูล: รองศาสตราจารย์ ดร.เจริญศรี ธนบุญสมบัติ
ชื่ออาจารย์ที่ทำวิจัย: รองศาสตราจารย์ ดร.เจริญศรี ธนบุญสมบัติ
ชื่อนักศึกษาที่ทำวิจัย: Chen Ke
แหล่งทุนวิจัย: Mahidol University (MU-PD-2018-10) and the Thailand Research Fund (BRG-58-8-0002)
Collaboration: Professor Chanan Angsuthanasombat
ภาพถ่าย: Chen Ke
Tags: Inhibitory Zn2+-binding site, metallopeptidase, methicillin- resistant Staphylococcus aureus, peptidoglycan binding, staphylolytic activity, Zn2+-chelation
