Highlight
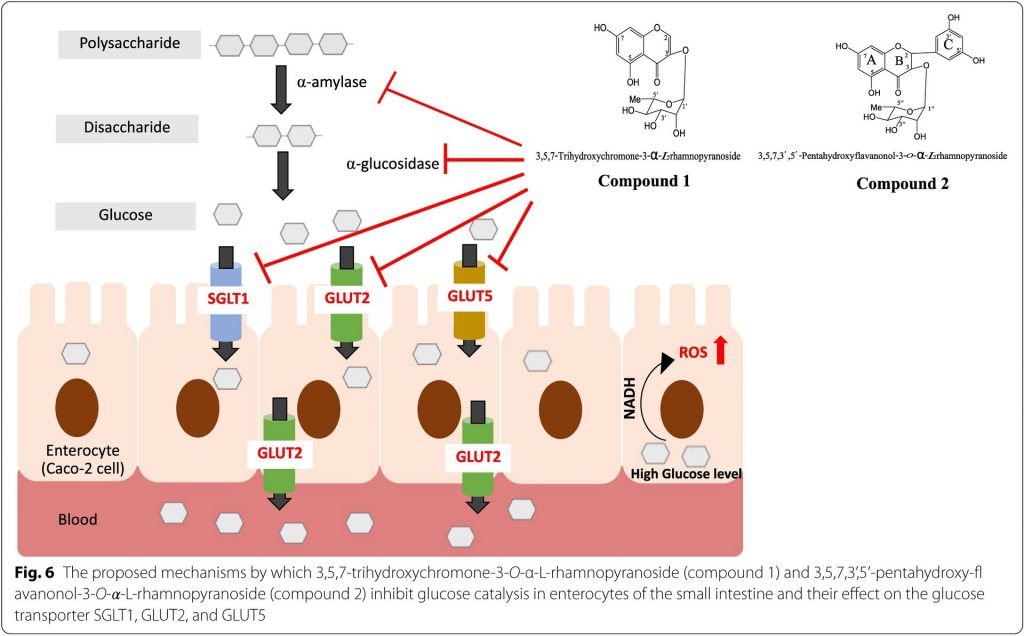
ในงานวิจัยนี้ พบว่าสารลำดับที่ 1 สามารถยับยั้งการทำงานของ α-amylase เหมือนกับสาร acarbose โดยมีค่า IC50 ประมาณ 3.32 ± 0.30 μg/mL และ 2.86 ± 0.10 μg/mL ตามลำดับ นอกจากนี้ยังพบสารที่ 2 มีการยังยั้งได้ปานกลางและมีค่า IC50 = 10.15 ± 0.53 μg/mL นอกจากนี้สารทั้ง 2 ชนิด ยังสามารถยับยั้ง α-glucosidase โดยมีค่า IC50 ประมาณ 5.35 ± 1.66 μg/mL, 510.15 ± 1.46 μg/mL ตามลำดับ และดีกว่า สาร acarbose ที่มี IC50 = 736.93 ± 7.02 μg/mL เมื่อนำมาทดสอบกับเซลล์มะเร็งเยื่อบุลำไส้ Caco-2 cells สารสกัดจากใบย่านางแดงทั้งสองชนิดและ acarbose มีฤทธิ์ในการยับยั้งการทำงาน α-glucosidase โดยไม่มีความเป็นพิษต่อเซลล์ นอกจากนี้ สารสกัดทั้งสองอย่างมีผลต่อวิถีสัญญาณของ glucose uptake โดยลดการแสดงออกของ SGLT1, GLUT2, and GLUT5 ในเซลล์ Caco-2 รวมทั้งภาพการจำลองทางคอมพิวเตอร์สามารถยืนยันได้ว่าสารสกัดทั้ง 2 ชนิด สามารถจับกับ SGLT1 and GLUT2 ได้ดี ดังนั้นสารสกัดทั้งสองสารนี้อาจจะมีประโยชน์ในการเป็นผลิตภัณฑ์เสริมอาหารสำหรับผู้ป่วยที่เป็นโรคเบาหวาน type 2
ที่มาและความสำคัญ
Lysiphyllum strychnifolium (Craib) A. Schmitz หรือ พืชสมุนไพร ที่ชื่อ “ ย่านางแดง” ที่มีองค์ประกอบของสารกลุ่ม polyphenols และ flavonoids ที่มีบทบาทต่อการออกฤทธ์ทางเภสัชวิทยา เช่น การต้านสารอนุมูลอิสระ การต้านมะเร็ง การต้านเชื้อจุลินทรี และ การต้านเบาหวาน แต่อย่างไรก็ตามกระบวนการของสารบริสุทธิ์จากย่านางแดงต่อการตอบสนองต่อน้ำตาลกลูโคส glucose ที่ลำไส้เล็กและฤทธิ์ต่อ glucose transporter ยังไม่มีการศึกษาในปัจจุบัน
Abstract
Background
Lysiphyllum strychnifolium (Craib) A. Schmitz, a traditional Thai medicinal plant, is mainly composed of polyphenols and flavonoids and exhibits several pharmacological activities, including antioxidant, anticancer, antimicrobial, and antidiabetic activities. However, the mechanism by which pure compounds from L. strychnifolium inhibit glucose catalysis in the small intestine and their effect on the glucose transporter remain unknown.
Methods
The objectives of this research were to examine the effect of 3,5,7-trihydroxychromone-3-O-𝛼-L-rhamnopyranoside (compound 1) and 3,5,7,3’,5’-pentahydroxy-flavanonol-3-O-𝛼-L-rhamnopyranoside (compound 2) on the inhibition of α-amylase and α-glucosidase, as well as glucose transporters, such as sodium-glucose cotransporter 1 (SGLT1), glucose transporter 2 (GLUT2), and glucose transporter 5 (GLUT5), using Caco-2 cells as a model of human intestinal epithelial cells. Additionally, the binding affinity and interaction patterns of compounds against two receptor proteins (SGLT1 and GLUT2) were determined for the first time utilizing a molecular docking approach.
Results
In the α-amylase inhibition assay, a concentration-dependent inhibitory response was observed against the enzyme. The results indicated that compound 1 inhibited α-amylase activity in a manner similar to that of acarbose (which exhibit IC50 values of 3.32 ± 0.30 µg/mL and 2.86 ± 0.10 µg/mL, respectively) in addition to a moderate inhibitory effect for compound 2 (IC50 = 10.15 ± 0.53 µg/mL). Interestingly, compounds 1 and 2 significantly inhibited α-glucosidase and exhibited better inhibition than that of acarbose, with IC50 values of 5.35 ± 1.66 µg/mL, 510.15 ± 1.46 µg/mL, and 736.93 ± 7.02 µg/mL, respectively. Additionally, α-glucosidase activity in the supernatant of the Caco-2 cell monolayer was observed. In comparison to acarbose, compounds 1 and 2 inhibited α-glucosidase activity more effectively in Caco-2 cells without cytotoxicity at a concentration of 62.5 µg/mL. Furthermore, the glucose uptake pathways mediated by SGLT1, GLUT2, and GLUT5- were downregulated in Caco-2 cells treated with compounds 1 and 2. Additionally, molecular modeling studies revealed that compounds 1 and 2 presented high binding activity with SGLT1 and GLUT2.
Conclusion
In summary, our present study was the first to perform molecular docking with compounds present in L. strychnifolium extracts. Our findings indicated that compounds 1 and 2 reduced glucose uptake in Caco-2 cells by decreasing the expression of glucose transporter genes and inhibiting the binding sites of SGLT1 and GLUT2. Therefore, compounds 1 and 2 may be used as functional foods in dietary therapy for postprandial hyperglycemia modulation of type 2 diabetes.
Keywords: L. strychnifolium, α-amylase, α-glucosidase, Caco-2 cell, Glucose transporters
Citation: Noonong, K., Pranweerapaiboon, K., Chaithirayanon, K. et al. Antidiabetic potential of Lysiphyllum strychnifolium (Craib) A. Schmitz compounds in human intestinal epithelial Caco-2 cells and molecular docking-based approaches. BMC Complement Med Ther22, 235 (2022). https://doi.org/10.1186/s12906-022-03706-x
RELATED SDGs:
3. GOOD HEALTH AND WELL-BEING

15: LIFE ON LAND

ผู้ให้ข้อมูล: รองศาสตราจารย์ ดร.กุลธิดา ชัยธีระยานนท์
ชื่ออาจารย์ที่ทำวิจัย: รองศาสตราจารย์ ดร.กุลธิดา ชัยธีระยานนท์
เครดิตภาพ: อาจารย์ ดร.กุลวดี หนูหนอง
Tags: Caco-2 cell, Glucose transporters, L. strychnifolium, α-amylase, α-glucosidase
